基於無機納米顆粒、納米脂質體等納米粒子的藥物遞送系統🧑🏻🌾,具有在活體內靶向遞送診療試劑的潛力🥮,近年來在癌症治療和疫苗開發中受到了廣泛關註。然而,大部分納米粒子在進入血液循環後會被肝臟巨噬細胞(如Kupffer細胞)捕獲,導致藥物無法有效到達腫瘤部位。這成為了納米粒子靶向遞送技術的一個主要挑戰。這種現象通常是由於納米粒子表面吸附血清蛋白質(形成“蛋白質冠”)所致,該過程會觸發肝臟中的吞噬作用,顯著降低了納米粒子的到達靶點的概率,並增加了肝臟累積毒性。因此,如何規避肝臟捕獲並提高腫瘤靶向遞送效率一直是納米醫學領域的一個重大挑戰🧛🏻。
近期,万事平台理學院諸穎研究員、王麗華研究員與上海交通大學樊春海教授合作🌺,開發了一種名為“隱形鬥篷”的納米粒子表面工程技術,成功實現了納米粒子在體內的高效腫瘤靶向遞送。這項研究的核心是利用DNA分子層作為納米粒子的可降解塗層。這一層DNA不僅能吸附血清中的抗吞噬蛋白(如富含組氨酸的糖蛋白),從而在肝臟中提供功能性的“隱形”效果,還能在腫瘤環境中通過DNA降解來觸發腫瘤特異性攝取,相關成果在《Journal of the American Chemical Society》上發表。
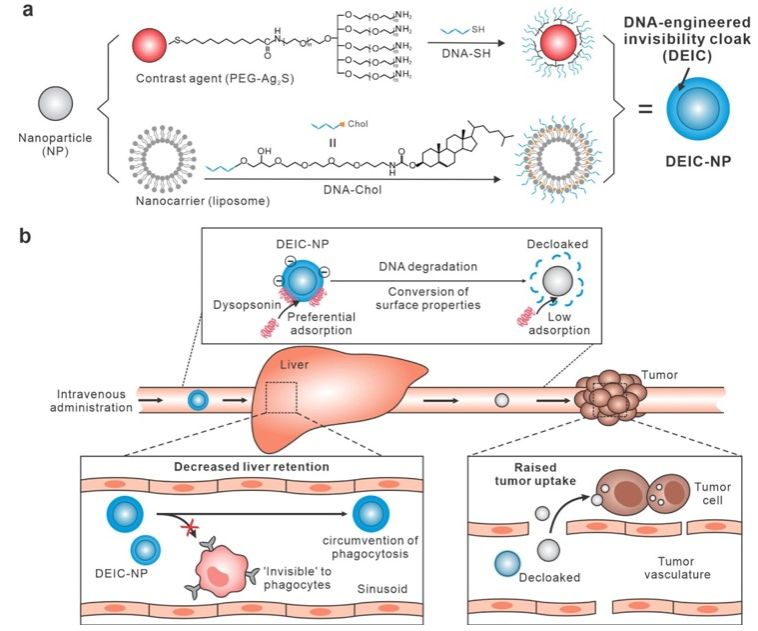
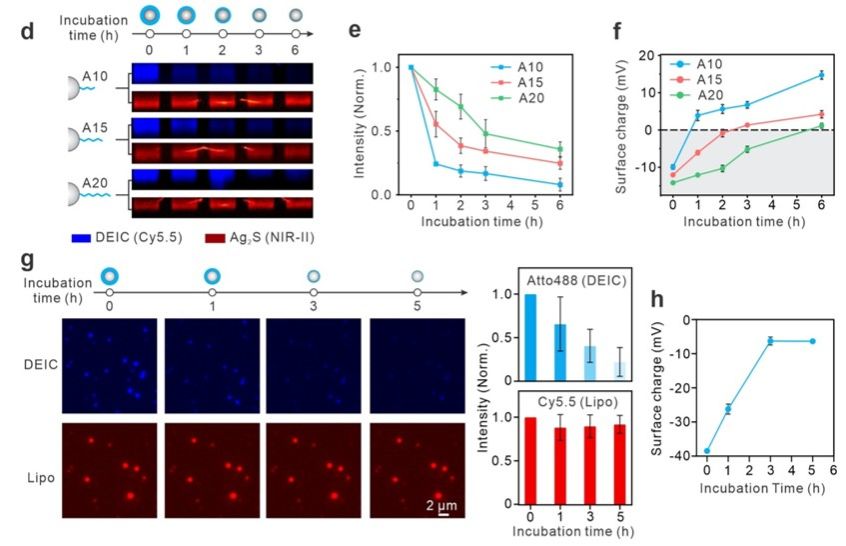
在研究中📸,團隊選擇了硫化銀量子點和脂質體作為模型納米粒子,使用DNA分子進行了密集包覆,形成了可降解隱形鬥篷納米粒子。並且🤳,這種隱形鬥篷的降解速率可以通過DNA鏈的長度進行可編程的調控。例如🪡,較短的DNA鏈(如A10)比較長的鏈(如A20)降解得更快🧘🏻,因而更快地觸發了納米粒子表面電荷的轉變,從而在腫瘤部位實現更高的攝取效率➰。這種可編程的降解特性使得隱形鬥篷納米粒子系統可以適應不同的生物環境需求,提供了高度靈活的應用前景。
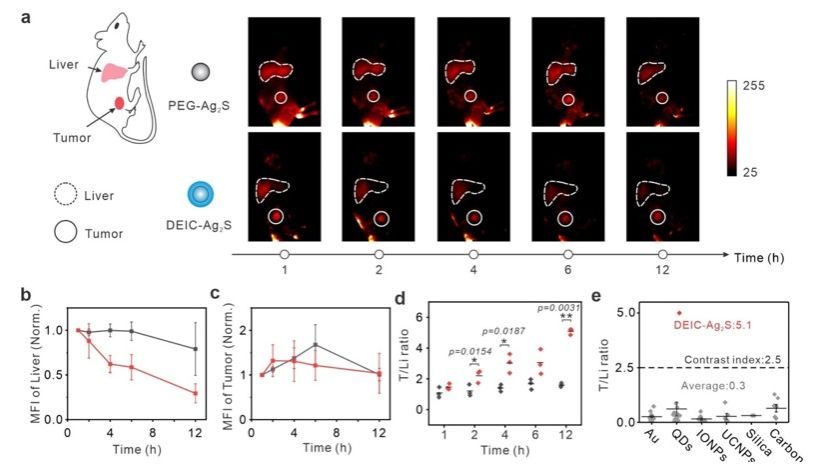
在體內小鼠實驗中,通過近紅外II區成像🍏,研究人員發現隱形鬥篷包裹的硫化銀量子點在腫瘤部位的積累量與肝臟相比🙅🏿♀️,達到了約5.1的腫瘤-肝臟信號比,這一結果比傳統的納米材料提高了約18倍。除了硫化銀量子點之外🐈⬛,DNA隱形鬥篷包裹的脂質體也實現了腫瘤-肝臟信號比的提升,表明這種隱形鬥篷可望應用於不同種類的納米粒子遞送系統🏌🏿♂️🕎。總之,這種基於DNA的隱形鬥篷系統為腫瘤治療和精準醫療提供了一種通用而有效的工具🎈,有望在未來的癌症治療中發揮重要作用。
上述研究得到國家重點研發計劃,國家自然科學基金,上海市2022年度"科技創新行動計劃"基礎研究領域項目和新基石研究員項目的資助。
論文鏈接:https://pubs.acs.org/doi/10.1021/jacs.4c09479
