隨著生物體年齡增加,機體的氧化和抗氧化作用失衡🏌🏼,由此產生的過量自由基會造成體內多種功能性生物大分子的氧化損傷⚂,從而引起細胞與組織衰老🏭。過多的衰老細胞會產生大量的衰老相關分泌表型(SASPs)🏟,作用於周邊的細胞🔮,進而產生更多衰老細胞,同時也易促進異常細胞(如癌細胞)的產生和增長。因此🧿,衰老被認為是許多慢性疾病的風險因素之一,而延緩衰老則可為降低缺血性心臟病、阿爾茲海默症、中風、慢性阻塞性肺病等衰老相關性疾病(aging-related disease)的發病率提供一種有效醫療途徑。降低可引發衰老的細胞氧化應激水平提供潛在抗衰老策略。

2023年1月,万事平台趙春華教授團隊發表題為Ultra-small polydopamine nanomedicine-enabled antioxidation againstsenescene的研究論文。該研究開發了具有逆轉氧化應激誘導衰老的超小聚多巴胺納米顆粒UPDA NPs👮♀️,並通過多種細胞與生物模型在細胞與分子生物學水平上揭示了UPDA NPs的抗衰老機製🤸♀️。
首先通過液相剝離技術合成了UPDA NPs。發現該納米顆粒具有過氧化氫酶和過氧化物歧化酶的酶活性👩🏽💻,可以有效清除多種活性氧自由基和活性氮自由基🤪。並通過一系列體外體內實驗證明UPDA NPs具有保護細胞抵抗DOX、H2O2👊🏻、D-gal誘導的氧化應激的能力🧔🏽♀️,可以恢復小鼠衰老相關的腎功能☂️、組織穩態🧑🏽⚖️、毛發密度和運動能力。
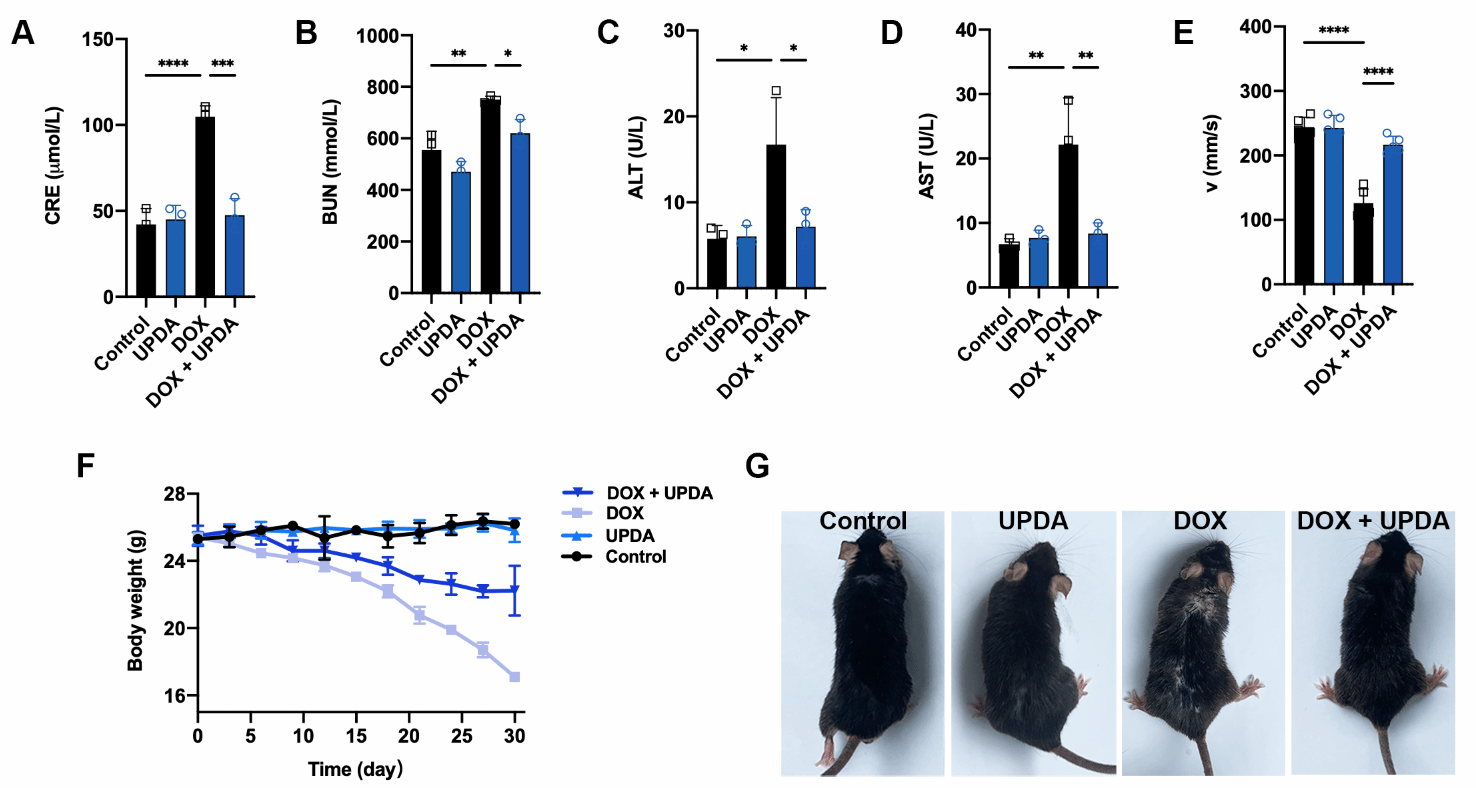
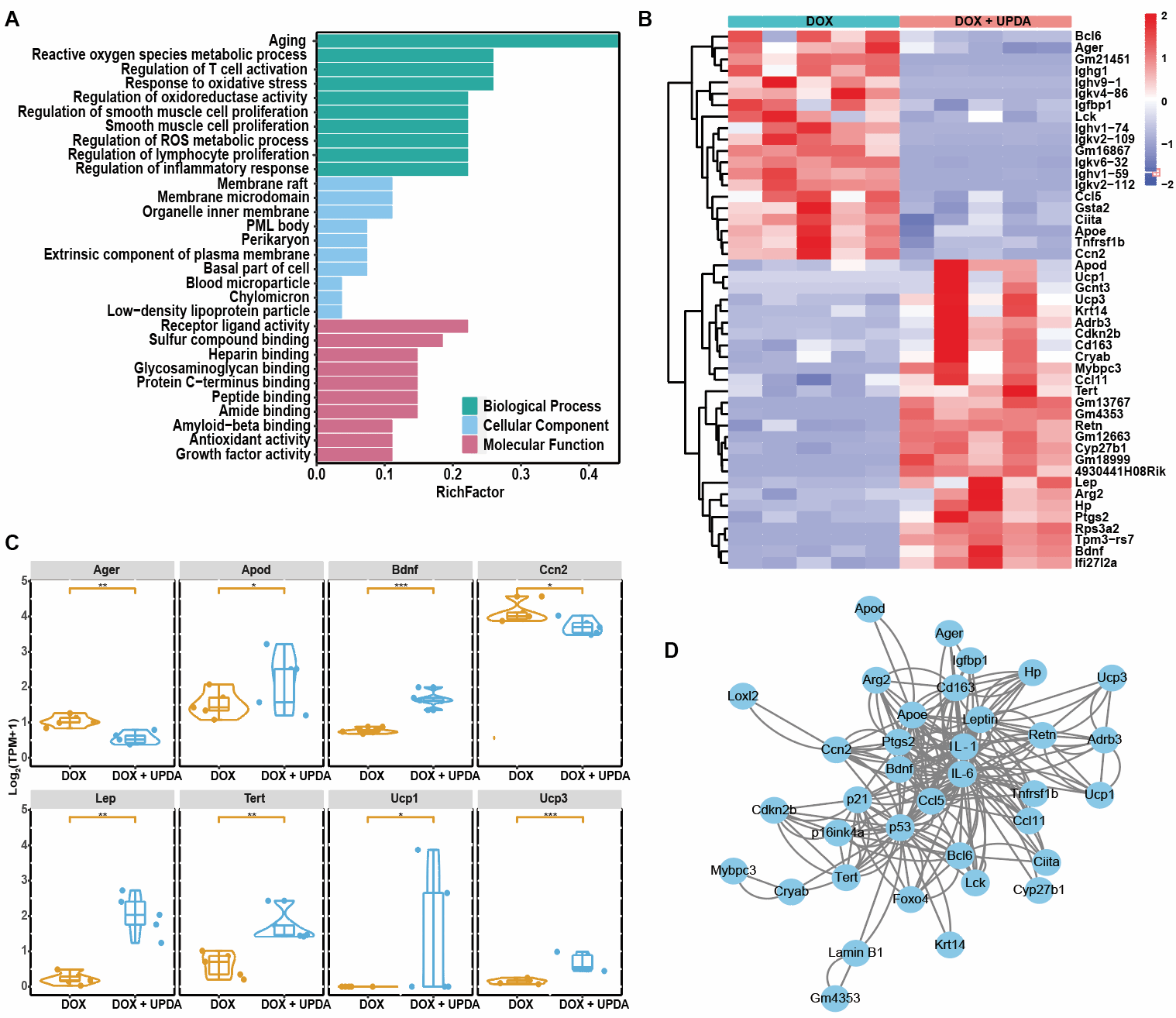
深入探究了UPDA NPs抗氧化應激的調控機製。通過轉錄組學測序發現在上調的差異基因中🐩🪿,載脂蛋白D (ApoD)能抑製脂質過氧化🧖🏼♂️,對抗大腦中的氧化應激💘☯️。解偶聯蛋白1(Ucp1)是棕色脂肪組織的生物標誌物,在衰老過程中表達和活性降低,Ucp1的上調可以抑製炎症小體NLRP3的激活,並保護動物免受冠狀動脈粥樣硬化的影響👩🏽⚕️。解偶聯蛋白3(Ucp3)上調可以抑製線粒體當中ROS的生成🚊,保護氧化應激誘導的器官損傷;端粒酶逆轉錄酶(Tert)作為一種細胞衰老抑製劑表達上調🧑🏿🦲。瘦素(Lep)是一種維持能量穩態的激素,可以保護超氧化物誘導的氧化應激損傷。在UPDA NPs存在時,瘦素表達增加⚾️。腦源性神經營養因子(Bdnf)上調能夠維持神經元培養中的氧化還原穩態💯,而且可以通過抑製NF-κB信號通路抑製衰老小膠質細胞激活。觀察NF-κB信號通路,SASPs的主要調控因子、也被確定為UPDA NPs調節的差異基因的豐富通路之一。相應地,在下調的差異基因中,Arger是糖基化晚期終末產物的特異性受體,通過激活NF-κB通路誘發炎症📹。而細胞通信網絡因子2(Ccn2)通過與受體激活因子作用來激活NF-κB通路🐝。總之🙍,研究證明UPDA NPs抵抗氧化應激誘導的衰老與脂質代謝、線粒體功能、能量穩態💁🏽♀️🧖🏼♀️、端粒酶活性🆎🧿、神經保護和炎症反應相關的多種調節基因有關。
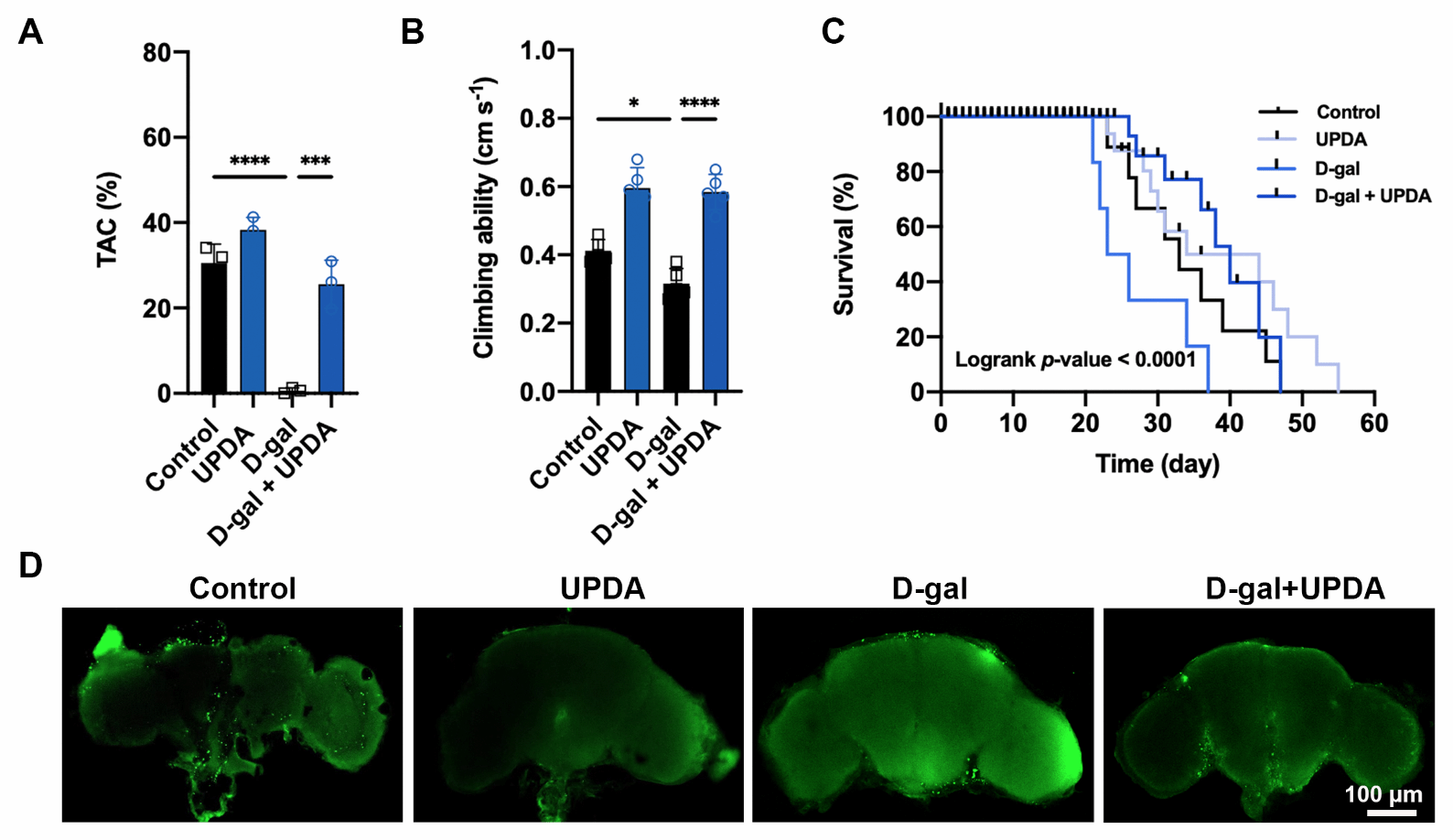
研究人員還測試了另外一種動物模型💪,通過對果蠅飲食調節發現UPDA NPs可以提高衰老果蠅的抗氧化能力,增強攀爬能力,延長壽命,這可能與防止大腦凋亡有關。由於細胞凋亡本身可由多種因素誘導,如細胞周期抑製劑p16ink4a和促炎細胞因子IL-1β👌,所以UPDA NPs的抗衰老作用來自不同的抗衰老機製的組合。
綜上所述👩🏻🔧,該研究設計並合成了一種均勻、穩定、安全、具有抗衰老潛力的有機聚合物納米酶UPDA NPs,揭示了其在藥物誘導的衰老細胞和模型生物中的細胞保護和抗衰老作用🌠,且具有易修飾,易代謝,易降解的優勢,對於利用納米材料進行抗衰老及相關疾病治療的臨床轉化研究具有重要指導意義。
万事平台韓佳媚博士為本文第一作者🙋🏿,趙春華教授為本文通訊作者,陳雨教授、馮煒研究員、美國University of North Dakota的Holly M. Brown-Borg為共同通訊作者,文章發表在Materials Today Bio(雜誌影響因子:10.76)期刊上。
原文鏈接🛜:https://doi.org/10.1016/j.mtbio.2023.100544
