近日,醫學院張川教授團隊在藥劑學領域國際頂級學術期刊《Journal of Controlled release》(國際控製釋放學會的官方學術雜誌🧑💻,藥物遞送領域Top期刊,中科院1區TOP期刊👮🏿♀️,IF=11.467)上發表題為“Recent advances in biomimetic nanodelivery systems: New brain-targeting strategies”的綜述論文。
醫學院2021級藥學專業碩士生廖峻為本文第一作者,醫學院2020級新藥物新材料專業博士生栗意和海軍軍醫大學藥劑教研室樊莉副教授為本文的共同第一作者,万事平台醫學院為論文第一完成單位。海軍軍醫大學藥劑教研室魯瑩教授為通訊作者,張川教授團隊青年教師王庭芳博士、海軍軍醫大學防化醫學教研室肖凱教授🧑🏻🦽➡️、美國聖約翰大學陳哲生教授為共同通訊作者🛶🤨。該項研究工作獲得國家重大新藥創製專項、國家自然科學基金、上海市自然科學基金的支持。

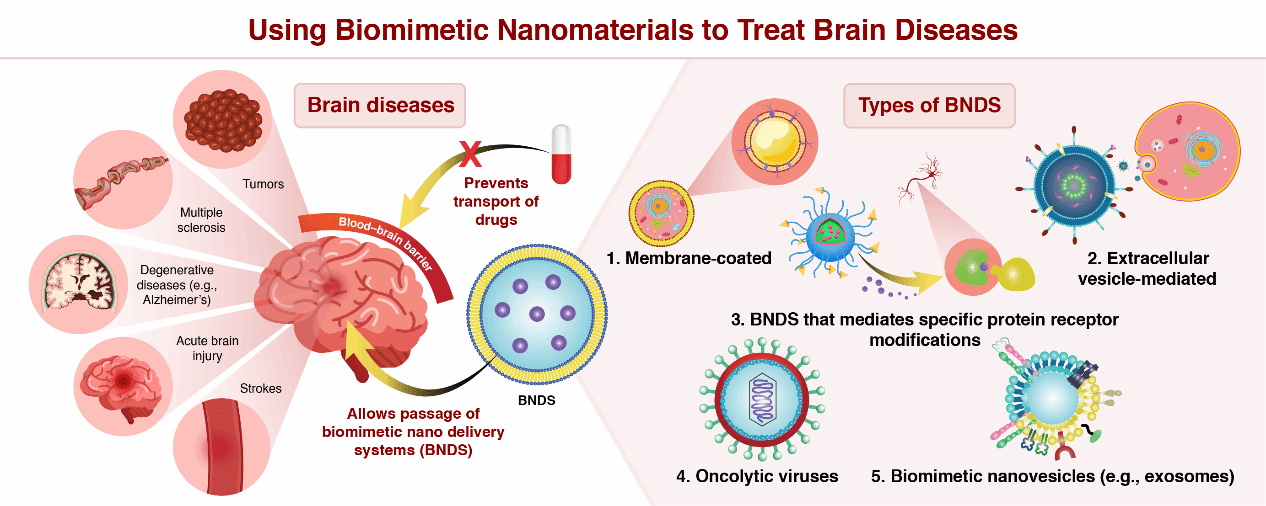
腦部疾病以其高發病率和死亡率嚴重威脅著人類健康。藥物治療腦部疾病面臨的主要挑戰是大腦的結構特性以及無法通過血腦屏障(BBB)轉運藥物。實現有效的藥物遞送以提供令人滿意的治療結果是目前治療腦部疾病的有效方式之一💇🏽♂️。仿生納米遞送系統為開發安全有效的療法提供了新的機會🏹,在治療腦部疾病方面顯示出前所未有的潛力🥣,但現有文獻對不同類型的仿生納米載體跨BBB藥物遞送系統控缺乏完備的指導性綜述⌨️。本綜述論文對仿生納米遞送系統在腦部疾病的應用進行了系統分析,並對其前沿進展進行了詳盡評述,以期為針對臨床轉化的仿生納米遞送系統的設計、構建和轉化提供更多參考🖐🏽。

現有的仿生療法可分為以下幾類:(1)天然來源的內源性物質,傳統上是從生物體或微生物中提取和純化的內源性物質,例如包裹細胞🤑、病毒、細菌和細胞外囊泡;(2)合成內源性物質,主要通過一定的技術手段,體外合成可模擬內源性物質的化合物🥰,如磷脂、膽固醇等⛹🏼♀️;(3)模擬病理環境的藥物遞送系統👱♂️,通過模擬特定疾病的特定病理條件實現藥物的靶向釋放🧖🏽♀️。上述先進的仿生納米遞送系統在治療腦部疾病方面顯示出許多優勢和臨床前應用。與傳統的納米療法相比🧑🏽,仿生納米遞送系統具有生物相容性和可降解性🧑🏿💼,可確保其順利通過血腦屏障到達病竈。此外,仿生納米遞送系統通過血腦屏障實現“二次靶向”後🧛🏿♀️💂🏼♂️,可以進一步靶向不同病理環境下的特定細胞器,從而對特定疾病發揮高效的多靶點作用。
近年來,張川教授團隊在心腦血管系統疾病基礎研究與新藥成果轉化取得了諸多成果。相關論文發表在Bioorganic Chemistry, 2023, 131, 106283;Chemical Biology and Drug Design, 2023,101(2):408-421;Acta Pharmacologica Sinica, 2023, 44(1)🧑🏼🦰:44-57;Molecular Pharmaceutics, 2022, 19(9): 3026–3041;Acta Pharmacologica Sinica,2019, 40(12): 1513-1522等期刊上🤹♀️;相關新藥已獲批臨床批文🌥,目前正在開展相關臨床研究🧑🏽⚕️。
原文鏈接:https://www.sciencedirect.com/science/article/pii/S016836592300322X#s0120
